
技術文章
TECHNICAL ARTICLES 更新時間:2025-09-02
更新時間:2025-09-02 點擊次數:20
點擊次數:20
ELISA實驗總重復不出?90%新手栽在這里!
ELISA(酶聯免疫吸附分析)利用抗原-抗體的免疫反應以及高效催化反應酶的有機結合而發展起來的一種綜合性技術,已成為多種生物標志物及生物活性檢測中的常客。早在今年2月,本公眾號轉發了題為酶聯免疫吸附測定(ELISA)新手上路:原理、類型及步驟考量的推文,幫大家理清了基礎流程。然而許多剛剛接觸ELISA實驗的小伙伴反饋,盡管對ELISA流程已經背的滾瓜爛熟,但是實驗結果總是令人沮喪——批間差異大,批內變異多,明明條件一樣,卻死活重復不出數據。別急,今天這篇推文聚焦本實驗室總結的最關鍵隱形坑,從操作步驟到影響程度,幫你把問題捋明白,更快上手ELISA!

一、抗原、抗體及分析物的稀釋:最關鍵也最易踩坑
很多人覺得“稀釋不就是加液體混勻嗎?",但恰恰是這步,藏著導致結果不穩定的核心原因。先給大家舉個常見例子:要配制4 mL、工作濃度為2 萬倍的抗體稀釋液,新手常犯的兩種操作,其實都有不小的誤差風險。
錯誤操作1:直接移取極少量原液稀釋
不少同學會直接移取0.4 μL抗體原液,加入8 mL PBS中(或0.2 μL原液加入4mL PBS),渦旋混勻后當作2萬倍稀釋液。
這種操作的問題,出在移液誤差上:移液時槍頭插入深度、槍頭/移液槍的批次差異、反復吹打的次數,都會影響實際移取體積。更關鍵的是,當移取體積小于1 μL時,誤差會被急劇放大——假設移液槍的固有誤差是±0.1 μL,移取0.4 μL時誤差率就達到±25%,而移取2 μL時誤差率僅±5%。這樣一來,不同批次配制的2萬倍稀釋液,實際濃度可能差出一大截,結果自然無法重復。
錯誤操作2:多次倍比稀釋+反復轉運
有些同學意識到少劑量的抗體/抗原并不能取準,會選擇“分步稀釋":先移取2 μL抗體原液到2.5 mL PBS中,渦旋配成2.5千倍稀釋液,通過重復倍比稀釋步驟,得到2萬倍稀釋液。
看似“謹慎",但這種方法不僅消耗更多抗體和耗材,還會因抗體的非特異性吸附導致濃度不準。抗體本質是蛋白質,會通過靜電作用、疏水作用(非共價鍵)吸附在EP 管等容器內壁——哪怕 PBS 能維持蛋白結構穩定,也只能輕微減弱這種吸附,無法wanquan避免。更麻煩的是,這種操作要經歷3次稀釋液轉運,每次轉運都會有5%-10% 的抗體吸附在容器壁上。按zuidi5% 損失計算,3次轉運后,最終稀釋液的實際濃度只剩理論值的86%(0.95×0.95×0.95≈0.86);若損失達 10%,多次倍比稀釋下的溶液最終濃度甚至會降到目標濃度的六成以下(0.93≈0.73,0.94≈0.66,0.95≈0.59)。
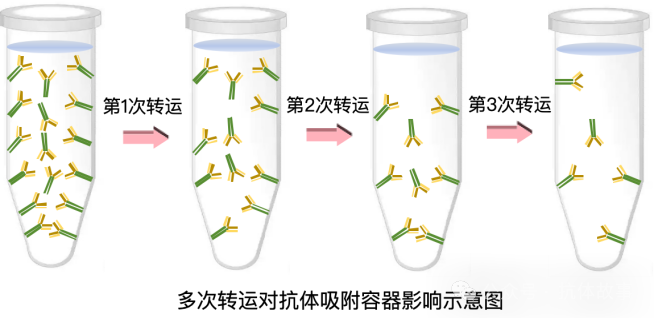
我們也做過對照試驗驗證:同樣是配制2萬倍稀釋液,4-5次倍比稀釋后,實測OD值比直接稀釋組下降了近50%。這種稀釋步驟的差異,還會導致 “方陣滴定找到的最佳反應量" 與 “后續標曲建立的濃度" 不匹配,進一步放大結果誤差。另外要提醒的是,相關研究表明蛋白質的非特異性吸附還受稀釋液在容器中的停留時間、環境溫度、容器材質的影響,所以實驗中必須盡可能統一這些條件。
正確操作:分裝凍存+一步稀釋,減少誤差
1.先分裝抗體,避免反復凍融
拿到抗體后,先分成兩部分:一部分作為原液分裝成小劑量密封凍存(-20℃或-80℃),另一部分加入“凍存保護液"(甘油+PBS,甘油體積占比>30%,防止凍融時蛋白變性),按效價稀釋20-200倍備用。這樣既能保證批間濃度穩定,也能避免原液意外污染或浪費。
2.低濃度時加BSA,維持蛋白穩定
通常來講,如果稀釋后抗體終濃度低于10 μg/mL,記得在稀釋液中加入少量牛血清蛋白(BSA),BSA能模擬抗體的生存環境以充當其在體外儲存的“保護劑",減少抗體因濃度過低導致的構象改變,保證反應活性。
3.一步稀釋到位,減少轉運
還是以配制4 mL 2W倍抗體稀釋液為例:直接取20 μL提前稀釋好的100倍抗體液,加入4 mL PBS中渦旋混勻即可。
Tips:這里有個小疑問,要不要扣除抗體溶液本身的體積?其實我們認為,只要加入的抗體液體體積不超過總體積的2%(比如4 mL總體系中加20 μL,占比0.5%),對最終濃度的影響可以忽略,不用額外計算。
二、移液槍加樣熟練度:別讓“手抖" 毀了整板實驗
如果說稀釋是ELISA 的 “基礎工程",那移液槍加樣技巧就是決定結果穩定性的關鍵工序。哪怕導師反復強調移液規范,很多新手還是會忽略:看似簡單的吸液-加液,其實藏著影響批內批間差異的大問題。新手常犯的2個加樣誤區:
1.手抖濺液,貼壁加樣救場?
新手加樣時容易手抖,導致液體濺出酶標孔外。這時不少人會下意識把移液槍槍頭抵住酶標孔壁加樣,覺得這樣更穩——但這是典型的“錯上加錯"。
一方面,貼壁加樣會讓液體順著孔壁流下,無法快速與孔內已有的靶標/抗原充分混合,導致結合反應不chedi;另一方面,槍頭接觸孔壁時,可能會把前一孔的液體帶到相鄰孔,造成交叉污染。最終的結果就是:同一批次內,不同孔的檢測值差異顯著,數據根本沒法用。
2.忽視加樣力度與速度,反應體系“失衡"
以間接競爭ELISA為例,shouci加入50 μL PBS或標準品時,液體量通常無法wanquan覆蓋酶標板底部。這時候,后續抗體加樣的 “沖擊力" 就很關鍵,合適的沖擊力能讓液體快速混勻,確保反應充分;但如果力度不當,要么混合不勻,要么濺起液體污染孔壁。
更易被忽略的是移液槍性能差異:不同品牌、不同最大量程、不同通道數的移液槍,“一槍到底"時的沖擊力wanquan不同。如果重復試驗中使用具有差異較大的移液器,結果則會參差不齊。
另外,加樣速度也會拉大批間差異。對96孔板用單槍加樣時,熟練后需控制在一分半鐘以內。如果加樣太慢,先加樣的孔已經開始反應,后加樣的孔才剛接觸試劑,相當于不同孔的反應時間差了好幾分鐘,結果自然無法平行。
正確加樣操作:3個關鍵參數+反復練習
想要掌握穩定的加樣技巧,核心是記住這幾個要點,再通過反復練習形成肌肉記憶:
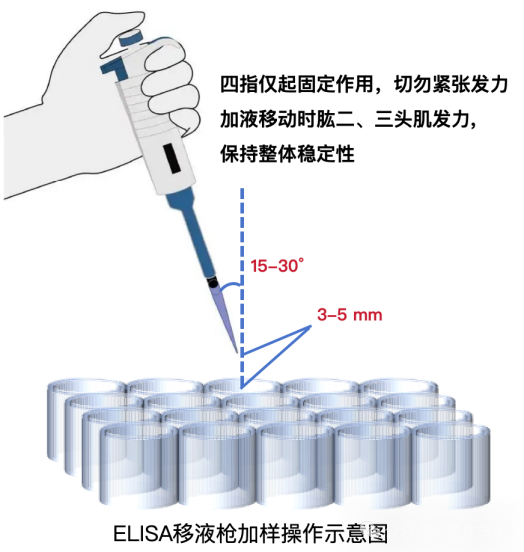
角度:移液槍槍頭與垂直方向可保持15-30° 夾角,既避免垂直加樣時手指無法穩定發力,也能確保液體精準入孔。
高度:槍頭距離酶標孔上沿3-5 mm,不要太高(防止液體濺出),也不要太低(避免接觸孔壁污染)。
速度與力度:快速、穩定地將液體注入孔中,利用液體注入的沖擊力讓孔內組分充分混合(不用額外吹打,避免氣泡產生)。
記住:哪怕理論記得再熟,只有通過幾百上千次的加樣練習,才能做到“手不抖、液不濺、速度穩"。
三、其他“隱形殺手":這些細節最易被忽略
除了稀釋和加樣,ELISA實驗中還有幾個 “不起眼" 的細節,實則對結果影響極大,新手往往栽在這些地方。
1.溫度
溫度對ELISA的影響,體現在實驗的每一步:溶液配制、加樣、孵育,哪怕是1-2℃的差異,都可能讓結果跑偏。對于沒有恒溫條件的實驗室,早中晚室溫差異明顯(比如早上22℃、中午26℃),直接導致不同批次的反應速率不同;甚至同一批次實驗,從冰箱拿出來的試劑沒回溫就直接用,也會讓局部反應溫度過低。孵育箱 “位置差":酶標板的擺放位置也會影響加熱速度,靠近孵育箱內壁的酶標板升溫更快,中間的升溫慢,這會加劇“邊際效應"(酶標板周邊孔的讀數比內側孔高)。
建議:實驗前先讓試劑回溫至室溫(通常25℃),孵育時將酶標板放在孵育箱中間位置,若需多次實驗,盡量固定在每天同一時間段進行,減少溫度波動。
2.通用試劑的適配性:別迷信萬能配方
很多人覺得“ELISA 通用試劑隨便用就行",但實際上,試劑與實驗體系的 “適配性" 比 “通用性" 更重要。以封閉液為例,大部分實驗用脫脂奶粉封閉沒問題,但遇到某些特殊抗體(比如某些納米抗體和針對糖基化位點的抗體)時,脫脂奶粉中的成分可能無法wanquan封閉酶標板空白位點,或與抗體發生非特異性結合,導致背景信號飆升、檢測靈敏度下降。此外,基礎緩沖液與顯色液:PBS、CB、二抗、顯色液等,也可能存在批次失效或體系不兼容的問題。比如PBS存放過久pH值偏移,會影響抗原-抗體結合;顯色液過期則會導致顯色變淺,讀數偏低。
娜連生物建議:當實驗出現多次非預期結果(如背景高、標曲線性差)時,別只排查抗原抗體,先對所有試劑做交叉驗證,排除試劑適配性問題。

掃碼加微信
 服務熱線
服務熱線
 上海市奉賢區南行港路2900號1幢一層
上海市奉賢區南行港路2900號1幢一層
 718497202@qq.com
718497202@qq.com
Copyright © 2025上海娜連生物科技有限公司 All Rights Reserved 備案號:滬ICP備2025116180號-3
技術支持:化工儀器網 管理登錄 sitemap.xml